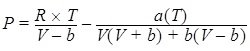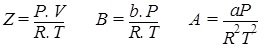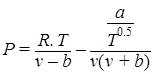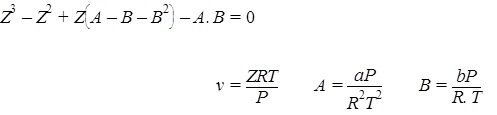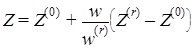قبل از پرداختن به مبحث معادلات ترمودینامیکی، معرفی و نحوهی انتخاب آنها، لازم است با رفتار فازی سیستم آشنا شویم.
تمام موادی که در اطراف ما هستند در سه فاز جامد، مایع و گاز وجود دارند. فاز، کمیتی از ماده تعریف میشود که بهصورت فیزیکی قابلتشخیص و جداسازی از قسمتهای دیگر سیستم باشد. شرایط فازی به دما و فشار سیستم بستگی دارد. جسمی جامد را در نظر بگیرید. در این جسم، مولکولها توسط نیروهای جاذبهی قوی در کنار هم قرارگرفتهاند و فقط در جای خود حرکت چرخشی دارند. درصورتیکه دمای سیستم افزایش و یا فشار سیستم کاهش یابد، مولکولها انرژی جنبشی و آزادی بیشتری برای حرکت پیداکرده، کمکم از حالت بستهی خود خارجشده و جاری میشوند. در این حالت فرایند تغییر فاز رخداده و فاز جامد به فاز مایع تبدیل میشود.
فازهای یک ماده، میتوانند بهصورت تک فازی و یا چند فاز در کنار هم وجود داشته باشند. همچنین هر فاز میتواند بهصورت یکجزیی و یا چندجزیی باشد. کلمهی جز به تعداد گونههای مولکول یا اتم موجود در ماده اطلاق میشود. یک سیستم تکجزیی فقط شامل یک نوع اتم یا مولکول است. مباحث مربوط به مواد خالص و سیستمهای دوفازی و بررسی شرایط و خواص آنها، مبنای تحقیقات برای رسیدن به خواص سیستمهای پیچیدهتر شامل اجزای بیشتر است.
برای مطالعهی دقیقتر رفتار فازی مواد، از نمودارهای فازی استفاده میشود. این نمودارها بهصورت سهبعدی هستند که رفتار پارامترهای P، T و V را در مقابل هم نشان میدهند اما برای راحتی کار، غالباً از نمودارهای دوفازی آنها استفاده میشود. این نمودارها شامل نمودارهای P-T، P-V و T-V میشوند. نمودار سهبعدی فازی برای یک مادهی خالص بهصورت زیر است:
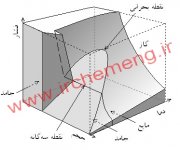
این نمودار در سه صفحهی فشار، دما و حجم رسم شده است. از تصویر این نمودار در صفحهی P-V نمودار P-V مادهی خالص حاصل میشود و به همین ترتیب میتوان نمودارهای T-V و P-T را نیز ترسیم کرد.ابتدا لازم است که چند اصطلاح را تعریف کنیم:

ناحیهی سمت چپ منحنی خطچین، ناحیهی تک فازی مایع و ناحیهی سمت راست منحنی، ناحیهی تک فازی گاز است. فضای محصور بین منحنی، محدودهای است که دو فاز مایع و گاز بهصورت دوفازی در تعادل باهم قرارگرفتهاند. فرض کنید در ابتدا سیستم شما در دمای ثابت T1 در نقطهی H که در ناحیهی تک فازی مایع است، قرار دارد. اگر مایع در یک سیلندر و پیستون قرار داشته باشد، میتوان با بالا بردن پیستون، فشار سیستم را کاهش داد. اگر بهتدریج فشار را کم کنیم، حالت سیستم روی خط HG تغییر کرده، حجم سیستم مقداری افزایشیافته و درنهایت به نقطهی G میرسد. در این نقطه اولین حباب گاز در مایع تشکیلشده که با مایع در حال تعادل است؛ بنابراین این نقطه، نقطهی حباب نامیده میشود. ازاینپس با حرکت مجدد روبه بالای پیستون، در ناحیهی دوفازی و تا جایی که هنوز فاز مایع داشته باشیم، فشار سیستم ثابت مانده و کیفیت افزایش مییابد. با حرکت در ناحیهی دوفازی، به نقطهی F میرسیم. در این نقطه که نقطهی شبنم نامیده میشود کل سیستم در فاز گاز بوده و فقط یک قطرهی کوچک مایع در تعادل با فاز گاز داریم. در ناحیهی دوفازی با کاهش فشار پیستون، به دلیل تولید گاز بیشتر، حجم پیوسته افزایش مییابد. بعد از نقطهی F با کاهش فشار، سیستم وارد ناحیهی تک فازی گاز میشود.
خط HGFE، خط دما ثابت است. درصورتیکه کاهش فشار در دماهای جدیدی انجام شود، خطوط دما ثابت و نقاط حباب و شبنم جدیدی حاصل میشود. منحنی خطچین سمت چپ که مکان هندسی نقاط حباب در دماهای مختلف است را منحنی حباب و منحنی خطچین سمت راست که مکان هندسی نقاط شبنم در دماهای مختلف است را منحنی شبنم مینامند.
با افزایش دما، منحنیهای دما ثابت هم بالاتر رفته و در دمایی خاص، دیگر ناحیهی دوفازی مشاهده نخواهد شد. این دما که در آن تفاوتی بین فاز مایع و بخار وجود نخواهد داشت را دمای بحرانی سیستم مینامند.
در نواحی تک فازی، بین پارامترهای دما، فشار و حجم رابطهای ریاضی وجود دارد که این رابطه بهصورت زیر نشان داده میشود:
بستهی موجود در نرمافزار هایسیس، دارای اطلاعات کاملی از انواع معادلات ترمودینامیکی با دقت بالایی است. در ادامه به بررسی معادلات حالت و سایر معادلات ترمودینامیکی میپردازیم.
تمام موادی که در اطراف ما هستند در سه فاز جامد، مایع و گاز وجود دارند. فاز، کمیتی از ماده تعریف میشود که بهصورت فیزیکی قابلتشخیص و جداسازی از قسمتهای دیگر سیستم باشد. شرایط فازی به دما و فشار سیستم بستگی دارد. جسمی جامد را در نظر بگیرید. در این جسم، مولکولها توسط نیروهای جاذبهی قوی در کنار هم قرارگرفتهاند و فقط در جای خود حرکت چرخشی دارند. درصورتیکه دمای سیستم افزایش و یا فشار سیستم کاهش یابد، مولکولها انرژی جنبشی و آزادی بیشتری برای حرکت پیداکرده، کمکم از حالت بستهی خود خارجشده و جاری میشوند. در این حالت فرایند تغییر فاز رخداده و فاز جامد به فاز مایع تبدیل میشود.
فازهای یک ماده، میتوانند بهصورت تک فازی و یا چند فاز در کنار هم وجود داشته باشند. همچنین هر فاز میتواند بهصورت یکجزیی و یا چندجزیی باشد. کلمهی جز به تعداد گونههای مولکول یا اتم موجود در ماده اطلاق میشود. یک سیستم تکجزیی فقط شامل یک نوع اتم یا مولکول است. مباحث مربوط به مواد خالص و سیستمهای دوفازی و بررسی شرایط و خواص آنها، مبنای تحقیقات برای رسیدن به خواص سیستمهای پیچیدهتر شامل اجزای بیشتر است.
برای مطالعهی دقیقتر رفتار فازی مواد، از نمودارهای فازی استفاده میشود. این نمودارها بهصورت سهبعدی هستند که رفتار پارامترهای P، T و V را در مقابل هم نشان میدهند اما برای راحتی کار، غالباً از نمودارهای دوفازی آنها استفاده میشود. این نمودارها شامل نمودارهای P-T، P-V و T-V میشوند. نمودار سهبعدی فازی برای یک مادهی خالص بهصورت زیر است:

این نمودار در سه صفحهی فشار، دما و حجم رسم شده است. از تصویر این نمودار در صفحهی P-V نمودار P-V مادهی خالص حاصل میشود و به همین ترتیب میتوان نمودارهای T-V و P-T را نیز ترسیم کرد.ابتدا لازم است که چند اصطلاح را تعریف کنیم:
- تبخیر: فرایند تغییر فاز ماده، از مایع به بخار را تبخیر مینامند. دمایی که در آن تبخیر رخ میدهد، دمای تبخیر نامیده میشود.
- میعان: عکس فرایند تبخیر بوده و به فرایند تغییر فاز، از مایع به گاز گفته میشود. دمای میعان عبارت است از دمایی که در آن میعان صورت میگیرد. برای یک مادهی خالص، دمای تبخیر و دمای میعان برابرند.
- ذوب: فرایند تغییر فاز ماده، از جامد به مایع را ذوب مینامند. دمایی که در آن ذوب شدن رخ میدهد، دمای ذوب نامیده میشود.
- انجماد: عکس فرایند ذوب بوده و به فرایند تغییر فاز، از مایع به جامد گفته میشود. دمای انجماد عبارت است از دمایی که در آن انجماد صورت میگیرد. برای یک مادهی خالص، دمای ذوب و دمای انجماد برابرند.
- نقطهی حباب: ظرفی شامل یک مایع خالص را در یک فشار معین در نظر بگیرید. هنگامیکه به مایع گرما داده شود، دمای آن بالا میرود و در دمایی خاص، اولین حباب گاز در آن ظاهر میشود. این نقطه را نقطهی حباب و دمای متناظر آن را دمای حباب در فشار سیستم مینامند. اگر در دمایی ثابت، فشار روی مایع را بهتدریج کم کنیم نیز در نقطهای اولین حباب گاز ظاهر میشود که فشار این نقطه را فشار حباب در دمای سیستم مینامند.
- نقطهی شبنم: ظرفی شامل بخاری خالص را در دمایی معین در نظر بگیرید. با افزایش فشار سیستم در دمای ثابت، بهجایی میرسیم که اولین قطرهی مایع در سیستم پدید میآید. این نقطه را نقطهی شبنم و فشار متناظر با آن را فشار شبنم در دمای سیستم مینامند. درصورتیکه دمای سیستم را در فشاری ثابت و معین کم کنیم نیز در نقطهای اولین قطرهی مایع تشکیل میشود که آن دما، دمای شبنم در فشار سیستم نامیده میشود.
- کیفیت: در یک سیستم دوفازی گاز-مایع، به نسبت جرم بخار به جرم کل سیستم، کیفیت گفته میشود. کیفیت تنها برای دو فاز در حال تعادل باهم تعریفشده و برای سیستمهای یکفازی معنایی ندارد.
- نقطهی بحرانی: بالاترین دما و فشاری است که دو فاز در کنار هم و در حالت تعادل میتوانند وجود داشته باشند.

ناحیهی سمت چپ منحنی خطچین، ناحیهی تک فازی مایع و ناحیهی سمت راست منحنی، ناحیهی تک فازی گاز است. فضای محصور بین منحنی، محدودهای است که دو فاز مایع و گاز بهصورت دوفازی در تعادل باهم قرارگرفتهاند. فرض کنید در ابتدا سیستم شما در دمای ثابت T1 در نقطهی H که در ناحیهی تک فازی مایع است، قرار دارد. اگر مایع در یک سیلندر و پیستون قرار داشته باشد، میتوان با بالا بردن پیستون، فشار سیستم را کاهش داد. اگر بهتدریج فشار را کم کنیم، حالت سیستم روی خط HG تغییر کرده، حجم سیستم مقداری افزایشیافته و درنهایت به نقطهی G میرسد. در این نقطه اولین حباب گاز در مایع تشکیلشده که با مایع در حال تعادل است؛ بنابراین این نقطه، نقطهی حباب نامیده میشود. ازاینپس با حرکت مجدد روبه بالای پیستون، در ناحیهی دوفازی و تا جایی که هنوز فاز مایع داشته باشیم، فشار سیستم ثابت مانده و کیفیت افزایش مییابد. با حرکت در ناحیهی دوفازی، به نقطهی F میرسیم. در این نقطه که نقطهی شبنم نامیده میشود کل سیستم در فاز گاز بوده و فقط یک قطرهی کوچک مایع در تعادل با فاز گاز داریم. در ناحیهی دوفازی با کاهش فشار پیستون، به دلیل تولید گاز بیشتر، حجم پیوسته افزایش مییابد. بعد از نقطهی F با کاهش فشار، سیستم وارد ناحیهی تک فازی گاز میشود.
خط HGFE، خط دما ثابت است. درصورتیکه کاهش فشار در دماهای جدیدی انجام شود، خطوط دما ثابت و نقاط حباب و شبنم جدیدی حاصل میشود. منحنی خطچین سمت چپ که مکان هندسی نقاط حباب در دماهای مختلف است را منحنی حباب و منحنی خطچین سمت راست که مکان هندسی نقاط شبنم در دماهای مختلف است را منحنی شبنم مینامند.
با افزایش دما، منحنیهای دما ثابت هم بالاتر رفته و در دمایی خاص، دیگر ناحیهی دوفازی مشاهده نخواهد شد. این دما که در آن تفاوتی بین فاز مایع و بخار وجود نخواهد داشت را دمای بحرانی سیستم مینامند.
در نواحی تک فازی، بین پارامترهای دما، فشار و حجم رابطهای ریاضی وجود دارد که این رابطه بهصورت زیر نشان داده میشود:
f(P,V,T)=0
رابطهای به این شکل که سه پارامتر فشار، دما و حجم را به هم مرتبط میسازد، معادلهی حالت نامیده میشود. سادهترین و شناختهترین معادلهای که این سه کمیت را به هم مرتبط میسازد، معادلهی حالت گازهای ایدهآل است.PV=ZnRT
دانشمندان و پژوهشگران بر اساس الگو گیری از این معادله و بررسی شرایط سیستمهای مختلف، تعداد زیادی از معادلات حالت جدید را به وجود آوردهاند که هرکدام دارای دقت و محدودهی کاری مخصوص به خود هستند. در هنگام شبیهسازی، بسته به نوع سیستم و شرایط آن، میبایست مناسبترین معادله انتخاب شود تا جوابهای نهایی از حالت واقعی خود انحراف کمی داشته باشند.بستهی موجود در نرمافزار هایسیس، دارای اطلاعات کاملی از انواع معادلات ترمودینامیکی با دقت بالایی است. در ادامه به بررسی معادلات حالت و سایر معادلات ترمودینامیکی میپردازیم.
آخرین ویرایش: